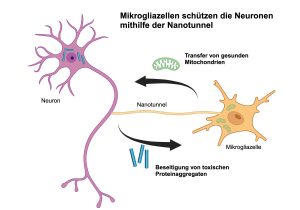
Das Gehirn enthält viele verschiedene Zelltypen, von den bekannten Neuronen bis hin zu den weniger bekannten Mikrogliazellen. Letztere spielen eine entscheidende Rolle: Sie sind Teil des Immunsystems des Gehirns und fungieren dort gewissermaßen als Reinigungsdienst. Eine aktuelle Studie von Forschern des Universitätsklinikums Bonn und des Luxembourg Centre for Systems Biomedicine (LCSB) der Universität Luxemburg, in Zusammenarbeit mit weiteren Wissenschaftlern aus Frankreich, Ungarn und Deutschland zeigt, dass sich diese Mikrogliazellen über so genannte Nanotunnel direkte mit den Neuronen verbinden können. Sie nutzen diese Verbindung, um toxische Proteine, die sich in den Neuronen ansammeln können, abzutransportieren und tragen so zu ihrer Gesundheit bei. Die Ergebnisse, die in der Fachzeitschrift Neuron veröffentlicht wurden, legen nahe, dass dieser Mechanismus eine entscheidende Rolle bei der Bekämpfung der Neurodegeneration spielt.
Die Anhäufung fehlgefalteter Proteine ist ein Merkmal verschiedener neurodegenerativer Erkrankungen wie der Alzheimer-Krankheit, der frontotemporalen Demenz und der Parkinson-Krankheit. Fehlgefaltete Proteine wie Alpha-Synuklein und Tau können sich in den Nervenzellen verklumpen und so die Zellfunktionen stören. „Wir wussten, dass Mikrogliazellen bei der Beseitigung dieser Proteinaggregate eine Rolle spielen, aber erst vor kurzem haben wir herausgefunden, dass sie Nanotunnel bilden können. Dies sind lange Fortsätze, die entfernte Zellen im Gehirn direkt miteinander verbinden“, erklärt Prof. Michael Heneka, Direktor des LCSB, Leiter der Neuroinflammation Gruppe und leitender Autor des Artikels. „Mit dieser Studie wollten wir den Transfer von biologischem Material zwischen Neuronen und Mikrogliazellen über diese Nanotunnel besser verstehen und die Auswirkungen dieses Austauschs auf die Zellgesundheit untersuchen“.
Anhand von Kulturen aus Nervenzellen und Mikrogliazellen von Mäusen oder aus menschlichen Stammzellen sowie modernster Mikroskopie konnten die Forscher zeigen, dass die Mikrogliazellen über Nanotunnel mit den Nervenzellen in Kontakt treten. So können sie die betroffenen Neuronen von toxischen Proteinverklumpungen befreien und ihnen gleichzeitig gesunde Mitochondrien, die Energiekraftwerke der Zellen, übergeben. Durch diesen doppelten Austausch wird der oxidative Stress der Neuronen deutlich reduziert, ihre normale Funktion wiederhergestellt und so die Nervenzellen geschützt.
Bildung von Nanotunneln live beobachten
Mithilfe einer Mikroskopietechnik an lebenden Zellen konnten die Wissenschaftler die Bildung von Verbindungen zwischen Neuronen und Mikrogliazellen live beobachten. „Weitere Forschungen sind notwendig, um die Bildung und Funktion dieser Nanotunnel im Detail zu verstehen, aber es ist wirklich spannend zu sehen, dass Mikrogliazellen eine aktive Rolle bei der Gesundheit von Neuronen spielen und ihnen bei Bedarf helfen können“, sagt Dr. Hannah Scheiblich, Erstautorin des Artikels, die mit Professor Heneka am Universitätsklinikum Bonn und am Deutschen Zentrum für Neurodegenerative Erkrankungen zusammengearbeitet hat.
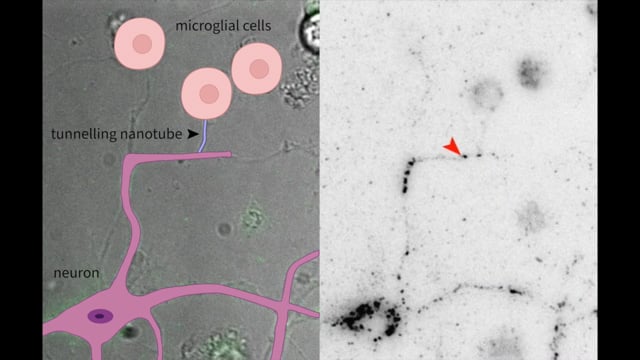
Das Video zeigt die Bildung von Nanotunneln zwischen Nervenzellen und Mikrogliazellen sowie den Transfer von Alpha-Synuklein-Aggregaten (roter Pfeil).
Dieses Video wurde mit einer in vitro Mikroskopietechnik an lebenden Zellen aufgenommen.
Mikrogliazellen als Retter der Neuronen
Bei der Kultivierung von Neuronen mit Mikrogliazellen beobachtete das Team, dass bei einer Anhäufung von toxischen Proteinen in den Neuronen die Anzahl der Nanotunnel, die die beiden Zelltypen verbinden, zunimmt und dass diese Verbindungen die Proteine Alpha-Synuklein und Tau enthalten. Diese toxischen Aggregate wurden von den Neuronen auf die Mikrogliazellen übertragen, nicht umgekehrt, und dann von den Mikrogliazellen abgebaut. Die Ergebnisse zeigen nicht nur, dass die Mikrogliazellen in der Lage sind, die betroffenen Neuronen wirksam zu entlasten, sondern auch, dass sie ihnen über die gleichen Nanotunnel auch Mitochondrien übertragen.
Mitochondrien sind wichtige Bestandteile der Zellen, und ihre Fehlfunktion kann zu Energiemangel und oxidativem Stress führen. Alpha-Synuklein und das Tau-Protein können die Funktion der Mitochondrien beeinträchtigen und so zum neurodegenerativen Prozess beitragen. Die Forscher stellten interessanterweise fest, dass die Mikrogliazellen durch den Transfer gesunder Mitochondrien die Energieproduktion in den betroffenen Neuronen wiederherstellten und so die oxidativen Schäden verringerten.
Insgesamt deuten diese Ergebnisse darauf hin, dass Mikrogliazellen und ihre Nanotunnel die Gesundheit von Nervenzellen fördern und das Fortschreiten der Neurodegeneration verlangsamen können. Dies, indem sie Proteinaggregate entfernen und funktionsfähige Mitochondrien an die Neuronen übertragen.
Den Einfluss bestimmter Genmutationen untersuchen
Anschließend untersuchten die Forscher, ob verschiedene genetische Mutationen, die mit neurodegenerativen Erkrankungen in Verbindung gebracht werden, einen Einfluss auf die Bildung der Nanotunnel und den entsprechenden Schutzmechanismus der Nervenzellen haben. Sie beobachteten, dass bestimmte Mutationen in den Genen LRRK2 und Trem2, die mit der Parkinson-Krankheit beziehungsweise der frontotemporalen Demenz in Verbindung gebracht werden, den Abbau toxischer Proteinaggregate vermindern oder die Versorgung mit funktionsfähigen Mitochondrien beeinträchtigen. Darüber hinaus könnten Veränderungen im Rac1-Gen, die mit der Parkinson-Krankheit in Verbindung gebracht werden, auch die Bildung von Nanotunneln beeinträchtigen.
Diese Ergebnisse weisen auf neue Mechanismen hin, durch die diese bekannten Genmutationen zu neurodegenerativen Erkrankungen beitragen. Indem sie die korrekte Funktion der Nanotunnel stören, hindern sie die Mikrogliazellen daran, die Nervenzellen wirksam zu schützen. Eine gezielte Beeinflussung dieser Mutationen, um die Bildung der Nanotunnel zu verbessern und den Transport zu aktivieren, könnte daher das Fortschreiten bestimmter neurodegenerativer Erkrankungen verlangsamen.
Vielversprechende Ergebnisse dank internationaler Zusammenarbeit
An der Forschungsarbeit waren mehrere internationale Kooperationspartner beteiligt, darunter Dr. Daniele Bano, Prof. Donato Di Monte und Prof. Eike Latz vom Deutschen Zentrum für Neurodegenerative Erkrankungen, Dr. Ádám Dénes vom l’Institute of Experimental Medicine in Budapest, Dr. Ronald Melki vom Institut de biologie François Jacob in Paris und Prof. Hans-Christian Pape von der Universität Münster. Dank dieser Teamarbeit und der gemeinsam gewonnenen Daten eröffnen die Ergebnisse neue Wege für ein besseres Verständnis des Gehirns und seiner Erkrankungen.
„Diese Studie vertieft nicht nur unser Verständnis der interzellulären Kommunikation durch Nanotunnel“, schließt Professor Michael Heneka. „Sie stellt auch die Hypothese in Frage, dass Mikrogliazellen die Neuroinflammation fördern, und deutet auf einen neuen Mechanismus der Neuroprotektion hin. Darauf könnten mögliche therapeutische Strategien gegen neurodegenerative Erkrankungen aufgebaut werden, die mit Alpha-Synuklein und dem Tau-Protein in Verbindung stehen.“
—
Referenz: H. Scheiblich, F. Eikens, L. Wischhof, S. Opitz, K. Jüngling, C. Cserép, S. V. Schmidt, J. Lambertz, T. Bellande, B. Pósfai, C. Geck, J. Spitzer, A. Odainic, S. Castro-Gomez, S. Schwartz, I. Boussaad, R. Krüger, E. Glaab, D. A. Di Monte, D. Bano, Á. Dénes, E. Latz, R. Melki, H-C. Pape & M. T. Heneka, Microglia rescue neurons from aggregate-induced neuronal dysfunction and death through tunneling nanotubes, Neuron, 25 July 2024.
Credits: Oberes Bild generiert mit BioRender.com