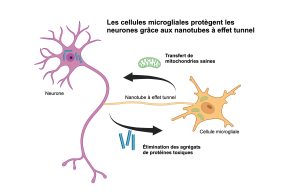
Le cerveau contient de nombreux types de cellules, des neurones dont nous avons tous entendu parler aux cellules microgliales, moins connues du grand public. Ces dernières jouent pourtant un rôle crucial : elles font partie intégrante du système immunitaire du cerveau et y font en quelque sorte office de service de nettoyage. Une étude récente menée par des chercheurs de l’Hôpital universitaire de Bonn et du Luxembourg Centre for Systems Biomedicine (LCSB) de l’Université du Luxembourg, en collaboration avec des scientifiques français, hongrois et allemands montre que ces cellules microgliales établissent des connexions avec les neurones par l’intermédiaire de nanotubes à effet tunnel. Elles utilisent ces minces tubes pour éliminer les protéines toxiques qui s’accumulent à l’intérieur des neurones, contribuant ainsi à améliorer la santé des neurones. Ces résultats, publiés dans la revue scientifique Neuron, suggèrent que ce mécanisme joue un rôle essentiel dans la lutte contre la neurodégénérescence.
Une accumulation anormale de protéines est une caractéristique de plusieurs troubles neurodégénératifs, dont la maladie d’Alzheimer, la démence fronto-temporale et la maladie de Parkinson. Des protéines telles que l’alpha-synucléine et la tau peuvent s’agréger à l’intérieur des neurones, perturbant ainsi le fonctionnement cellulaire. « Nous savions que les cellules microgliales jouaient un rôle dans l’élimination de ces agrégats de protéines mais ce n’est que récemment que nous avons appris qu’elle pouvait former des nanotubes à effet tunnel, de longues extensions capables de relier des cellules éloignées dans le cerveau, » explique le professeur Michael Heneka, directeur du LCSB, responsable de l’équipe Neuroinflammation et auteur principal de l’article. « Avec cette étude, nous voulions mieux comprendre le transfert de matériel biologique entre les neurones et les cellules microgliales via ces nanotubes et explorer les conséquences de cet échange pour la santé cellulaire. »
En utilisant des cultures de neurones et de cellules microgliales, issues de souris ou dérivées de cellules souches humaines, ainsi que de la microscopie de pointe, les chercheurs ont montré que les cellules microgliales établissent un contact avec les neurones par l’intermédiaire des nanotubes à effet tunnel (TNT). Cela leur permet de débarrasser les neurones affectés des agrégats de protéines toxiques et de leur transférer également des mitochondries, les centrales énergétiques des cellules. Ce double échange a pour effet de réduire considérablement le stress oxydatif des neurones, de rétablir leur fonctionnement normal et de protéger ainsi ces cellules nerveuses.
Observer la formation de nanotubes en direct
En utilisant une technique d’imagerie sur cellules vivantes, les scientifiques ont observé la formation de connexions entre les neurones et les cellules microgliales. « Des travaux de recherche complémentaires seront nécessaires pour comprendre en détails la formation et le fonctionnement de ces TNTs mais c’est vraiment passionnant de voir que les cellules microgliales jouent un rôle actif dans la santé des neurones et peuvent leur venir en aide en cas de besoin, » détaille Dr Hannah Scheiblich, premier auteur de l’article qui a travaillé avec le professeur Heneka à l’Hôpital universitaire de Bonn et au German Center for Neurodegenerative Diseases.
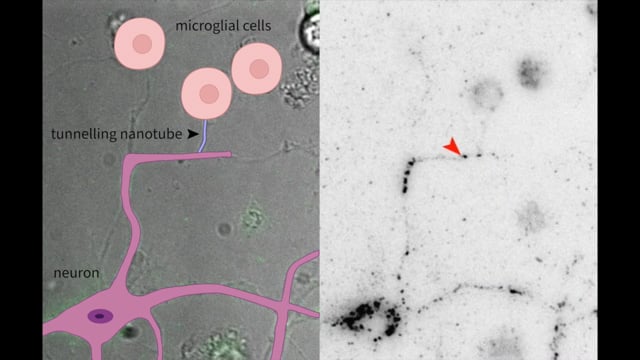
La vidéo ci-dessus montre la formation de TNTs entre un neurone et des cellules microgliales, et le transfert d’agrégats d’alpha-synucléine (flèche rouge) dans des cellules vivantes.
Cette vidéo a été filmée à l’aide d’une technique d’imagerie sur cellules vivantes in vitro.
Les cellules microgliales à la rescousse des neurones
En mettant en culture de neurones avec des cellules microgliales, l’équipe a observé que lorsque les protéines toxiques s’accumulent au sein des neurones, le nombre de TNT reliant les deux types de cellules augmente et que ces nanotubes contiennent des particules d’alpha-synucléine et de protéine tau. Ces agrégats toxiques étaient uniquement transférés des neurones aux cellules microgliales, et non l’inverse, et étaient ensuite dégradés par les cellules microgliales. Les résultats obtenus ont non seulement montré que les cellules microgliales peuvent soulager efficacement les neurones affectés par l’accumulation de protéines toxiques mais qu’elles leur transfèrent également des mitochondries par le biais des mêmes TNT.
Les mitochondries sont des composants importants des cellules et lorsqu’elles ne fonctionnent pas correctement, il peut en résulter des déficits énergétiques et un stress oxydatif. L’alpha-synucléine et la protéine tau peuvent altérer le fonctionnement des mitochondries, contribuant par ce biais au processus neurodégénératif. De manière remarquable, les chercheurs ont constaté que lorsque les cellules microgliales transfèrent des mitochondries saines aux neurones affectés, cela rétablit la production d’énergie et réduit les dommages oxydatifs, préservant ainsi efficacement le fonctionnement des neurones et assurant leur survie.
Dans l’ensemble, ces résultats suggèrent qu’en éliminant les agrégats de protéines et en transférant des mitochondries fonctionnelles vers les neurones, les cellules microgliales et leurs nanotubes favorise la bonne santé des cellules nerveuses et peuvent ralentir la progression de la neurodégénérescence.
Explorer l’impact de certaines mutations génétiques
Les chercheurs ont ensuite examiné si différentes mutations génétiques associées aux maladies neurodégénératives avaient un impact sur la formation des TNTs et sur les mécanismes de protection des neurones utilisant ces nanotubes. Ils ont observé que certaines mutations sur les gènes LRRK2 et Trem2, respectivement liées à la maladie de Parkinson et à la démence fronto-temporale, réduisent l’élimination des agrégats de protéines toxiques ou compromettent l’apport en mitochondries fonctionnelles. Par ailleurs, des altérations liées à la maladie de Parkinson sur le gène Rac1 pourraient également affecter la formation des nanotubes.
Ces résultats indiquent de nouveaux mécanismes par lesquels ces mutations génétiques connues contribuent aux maladies neurodégénératives. En effet, en perturbant le bon fonctionnement des TNTs, elles empêchent les cellules microgliales de protéger les neurones efficacement. Cibler ces mutations pour améliorer la formation de TNTs et activer les transferts via ces nanotubes pourrait donc permettre de freiner la progression de certaines maladies neurodégénératives.
Une collaboration internationale pour des résultats prometteurs
Ces travaux de recherche ont été mené avec plusieurs collaborateurs clés, dont Dr Daniele Bano, Prof. Donato Di Monte et Prof. Eike Latz du German Center for Neurodegenerative Diseases, Dr Ádám Dénes de l’Institute of Experimental Medicine de Budapest, Dr Ronald Melki de l’Institut de biologie François Jacob à Paris et Prof. Hans-Christian Pape de l’Université de Münster. Grâce à ce travail d’équipe et aux données générées en commun, les résultats obtenus ouvrent de nouvelles pistes pour une meilleure compréhension du cerveau et de ses maladies.
« Cette étude permet non seulement d’approfondir notre compréhension de la communication intercellulaire par le biais des nanotubes », conclut le professeur Michael Heneka. « Elle remet aussi en question l’idée que les cellules microgliales favorise la neuroinflammation, met en évidence un nouveau mécanisme de neuroprotection et donne un aperçu de possibles stratégies thérapeutiques contre les maladies neurodégénératives liées à l’alpha-synucléine et à la protéine tau. »
—
Référence : H. Scheiblich, F. Eikens, L. Wischhof, S. Opitz, K. Jüngling, C. Cserép, S. V. Schmidt, J. Lambertz, T. Bellande, B. Pósfai, C. Geck, J. Spitzer, A. Odainic, S. Castro-Gomez, S. Schwartz, I. Boussaad, R. Krüger, E. Glaab, D. A. Di Monte, D. Bano, Á. Dénes, E. Latz, R. Melki, H-C. Pape & M. T. Heneka, Microglia rescue neurons from aggregate-induced neuronal dysfunction and death through tunneling nanotubes, Neuron, 25 July 2024.
Image du haut créée avec BioRender.com