Kurz nach Beginn der COVID-19-Pandemie im Jahr 2020 wurde deutlich, dass bei einigen Menschen anhaltende Beschwerden über die akute Phase der SARS-CoV-2-Infektion hinaus auftreten. Dies wird nun als Long-COVID-Syndrom bezeichnet und bezieht sich auf eine Reihe von Symptomen, die über mehrere Wochen oder Monate nach der ursprünglichen Infektion anhalten. Zu den häufigsten Symptomen gehören Müdigkeit, Atembeschwerden, „Brain Fog“ und Gelenk- und Brustschmerzen.
Auf dieser Seite finden Sie weitere Informationen über das Long-COVID-Syndrom, seine Auswirkungen auf Gesundheit und Gesellschaft, aktuelle Behandlungsansätze und die bisherigen Erfahrungen des FastCoV-Studienteams mit ernährungsbezogenen klinischen Studien.
Das Long-COVID-Syndrom ist eine sehr variable Erkrankung, die in bis zu 10% der Fälle als postakute Komplikation einer SARS-CoV-2-Infektion auftritt. Die Weltgesundheitsorganisation (WHO) definiert das Long-COVID-Syndrom als Symptome, die mindestens 3 Monate nach der Primärinfektion auftreten, mindestens 2 Monate anhalten und keiner anderen Diagnose zugeordnet werden können.
Dauer, Ausprägung und Schweregrad der Symptome sind sehr unterschiedlich und reichen von Müdigkeit, Atemnot, Schmerzen, Depressionen und Angstzuständen bis hin zu kognitiven Beeinträchtigungen, die oft als „Brain Fog“ bezeichnet werden. Diese Symptome beeinträchtigen häufig die täglichen Aktivitäten, das Einkommen und die Lebensqualität der Betroffenen. Die zugrunde liegenden Ursachen des Long-COVID-Syndroms werden noch erforscht.
Gegenwärtige Hypothesen konzentrieren sich auf:
- Eine Fehlfunktion der Immun-Reaktion
- Eine Schädigung der Blutgefäße
- Eine Störung des zellulären Stoffwechsels
- Störungen des Verdauungssystems und seines Mikrobioms
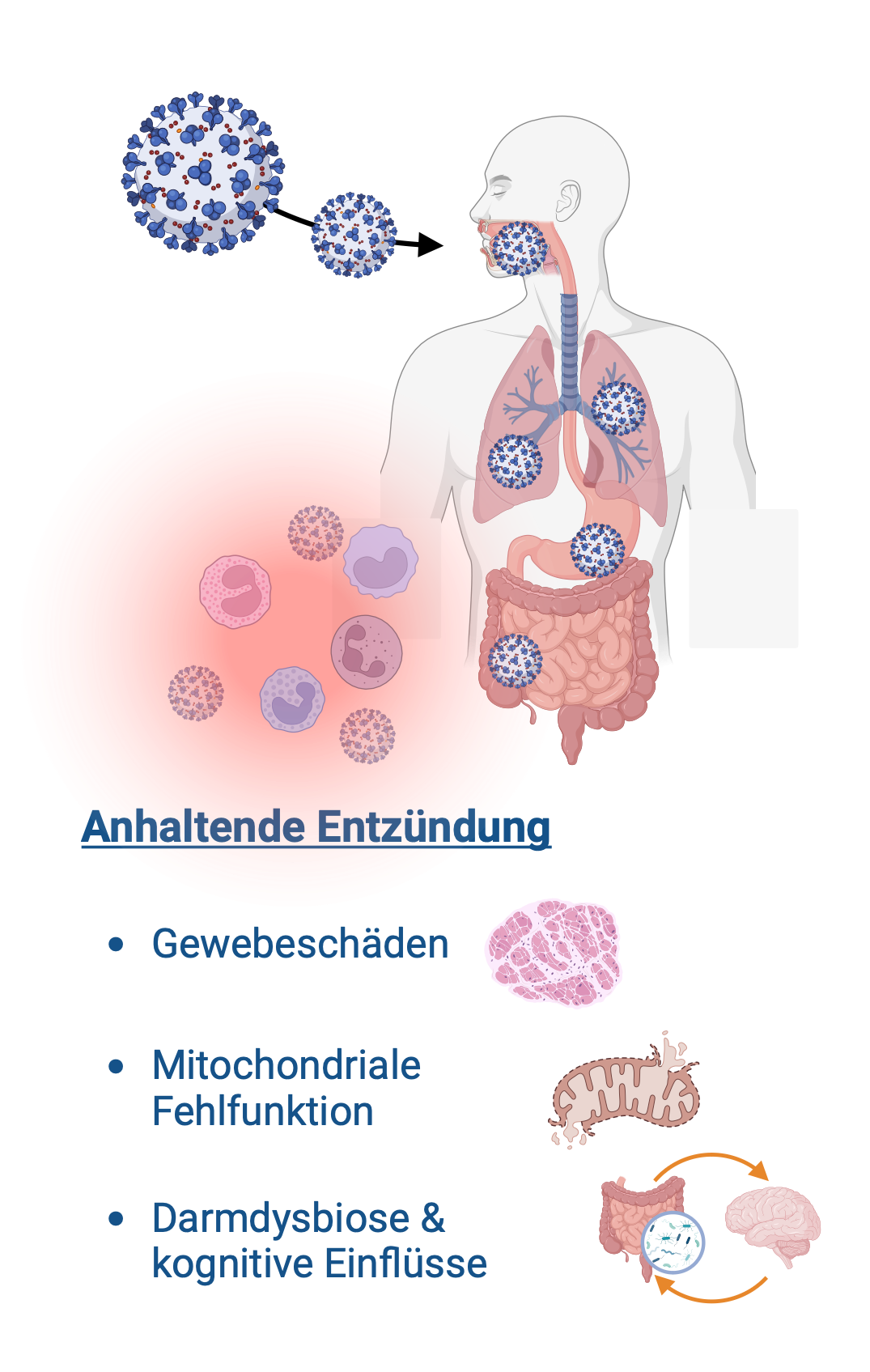
Es wird angenommen, dass die Erstinfektion eine Immunreaktion auslöst, die als Teil des normalen Abwehrmechanismus zu einer Entzündung führt. In einigen Fällen ist die Immunreaktion übermäßig oder fehlreguliert, was zu einer anhaltenden Entzündung und Organschädigungen führt. Dieser Prozess ist auch bei anderen chronischen Erkrankungen wie rheumatoider Arthritis, Diabetes und neurodegenerativen Erkrankungen weit verbreitet.
Weltweit sind derzeit mehr als 65 Millionen Menschen vom Long-COVID-Syndroms betroffen, wobei die meisten Patienten zwischen 36 und 50 Jahre alt sind. In den meisten Fällen handelt es sich um nicht hospitalisierte Personen, die unter Symptomen leiden, die ihre Gesundheit und ihre Lebensqualität beeinträchtigen. Darüber hinaus hat das Long-COVID-Syndrom soziale Auswirkungen, insbesondere am Arbeitsplatz, da viele Patienten ihre Arbeit reduzieren oder aufgeben müssen. Dies hat sozioökonomische Folgen wie erhöhte Abwesenheitsraten, verminderte Produktivität, soziale Isolation und erhöhten emotionalen Stress.
Obwohl die Entwicklung von entzündungshemmenden, antiviralen oder immunmodulierenden Medikamenten vielversprechend erscheint, konnte deren Wirksamkeit bei der Behandlung des Long-COVID-Syndroms noch nicht nachgewiesen werden. Bislang umfasst die Versorgung der Patienten personalisierte Behandlungspläne, die auf die Symptome des Einzelnen zugeschnitten sind, um ihre Lebensqualität so weit wie möglich zu verbessern. Diese symptomatischen Behandlungen können jedoch die teils noch unklaren Ursachen der Krankheit nicht bekämpfen. Die Erforschung und Entwicklung alternative therapeutische Lösungen ist daher dringend erforderlich.
Jüngste Forschungsergebnisse deuten darauf hin, dass Kalorienrestriktion und Fastendiäten Entzündungsprozesse reduzieren können, die eine mögliche zugrundeliegende Ursache des Long-COVID-Syndroms sind. Medizinisch überwachtes Fasten hat auch positive Auswirkungen auf andere Entzündungssyndrome und fördert eine gesunde mikrobielle Vielfalt im Darm. Eine kleine Studie zeigte, dass 13 von 14 Patienten mit chronisch entzündlichen Darmerkrankungen, die unter ärztlicher Aufsicht fasteten, eine Verbesserung ihrer Symptome erlebten.
Es wird daher davon ausgegangen, dass Fasten auch das komplexe Zusammenspiel von Immunreaktion, Stoffwechsel und Darmmikrobiom beim Long-COVID-Syndrom modulieren kann. Der Mangel an standardisierten Fastenprotokollen und die eingeschränkte objektive Beurteilung der Einhaltung des Protokolls durch die Studienteilnehmer erschweren jedoch die Durchführung solcher Interventionen und beeinträchtigen die Zuverlässigkeit und Reproduzierbarkeit bisheriger Ergebnisse. Dieses Projekt zielt darauf ab, diese Defizite zu überwinden und beinhaltet eine Pilotphase zur Evaluierung der Durchführbarkeit.
Das FastCov-Studienteam setzt sich aus Forschern verschiedener luxemburgischer und deutscher Institutionen zusammen. Jede Gruppe verfügt über umfangreiche Erfahrung in der Untersuchung der Auswirkungen der Ernährung auf verschiedene Aspekte der Gesundheit.
Die Gruppe des Luxembourg Centre for Systems Biomedicine der Universität Luxemburg hat kürzlich den Einfluss der Ernährung auf die kognitive Funktion von Menschen mit altersbedingten Hirnerkrankungen untersucht und analysiert, ob spezifische diätetische Interventionen einen Schutz bieten könnten. Darüber hinaus haben sie gemeinsam mit ihren Kollegen vom Department of Life Sciences and Medicine das Protokoll für die ExpoBiome-Studie entwickelt. Dabei handelt es sich um eine multizentrische klinische Studie, die den Zusammenhang zwischen Darm-Mikrobiom, Fasten und Immunstatus bei Patienten mit rheumatoider Arthritis und Parkinson untersucht.
Das Team der Berliner Charité hat zur NutriFast-Studie beigetragen, die die Wirksamkeit von Heilfasten und pflanzenbasierter Ernährung bei Menschen mit rheumatoider Arthritis untersucht. Durch die Analyse von getrockneten Blutstropfen konnten die Forscher mehrere Stoffwechselprodukte identifizieren, die während des Fastens erhöht sind und spezifische Wege aufzeigen, die an der Reaktion auf Kalorienrestriktion beteiligt sind.
Die Teilnahme an der FastCoV-Studie bedeutet also, dass Sie sich in die Hände eines erfahrenen Teams begeben, das Sie während der gesamten Studie begleitet: von der ersten Informationssitzung über regelmäßige Termine während der Fastenphase bis hin zur schrittweisen Rückkehr zur normalen Ernährung und der Nachsorge.
1. A. V. Raveendran, R. Jayadevan, and S. Sashidharan, “Long COVID: An overview,” Diabetes Metab. Syndr., vol. 15, no. 3, pp. 869–875, 2021, doi: 10.1016/j.dsx.2021.04.007.
2. D. L. Sykes, L. Holdsworth, N. Jawad, P. Gunasekera, A. H. Morice, and M. G. Crooks, “Post-COVID-19 Symptom Burden: What is Long-COVID and How Should We Manage It?,” Lung, vol. 199, no. 2, pp. 113–119, Apr. 2021, doi: 10.1007/s00408-021-00423-z.
3. L. Kohn et al., “Long COVID and return to work: a qualitative study,” Occup. Med. Oxf. Engl., vol. 74, no. 1, pp. 29–36, Feb. 2024, doi: 10.1093/occmed/kqac119.
4. M. S. Durstenfeld et al., “Association of nirmatrelvir for acute SARS-CoV-2 infection with subsequent Long COVID symptoms in an observational cohort study,” J. Med. Virol., vol. 96, no. 1, p. e29333, 2024, doi: 10.1002/jmv.29333.
5. X. Y. Loke, S. A. M. Imran, G. J. Tye, W. S. Wan Kamarul Zaman, and F. Nordin, “Immunomodulation and Regenerative Capacity of MSCs for Long-COVID,” Int. J. Mol. Sci., vol. 22, no. 22, Art. no. 22, Jan. 2021, doi: 10.3390/ijms222212421.
6. N. Nagata et al., “Human Gut Microbiota and Its Metabolites Impact Immune Responses in COVID-19 and Its Complications,” Gastroenterology, vol. 164, no. 2, pp. 272–288, Feb. 2023, doi: 10.1053/j.gastro.2022.09.024.
7. F. Grundler, R. Mesnage, A. Cerrada, and F. Wilhelmi de Toledo, “Improvements during long-term fasting in patients with long COVID – a case series and literature review,” Front. Nutr., vol. 10, p. 1195270, Nov. 2023, doi: 10.3389/fnut.2023.1195270.
8. B. Hansen, K. Roomp, H. Ebid and J.-G. Schneider. „Perspective: The Impact of Fasting and Caloric Restriction on Neurodegenerative Diseases in Human,“ Adv Nutr. 2024 Apr;15(4):100197. doi: 10.1016/j.advnut.2024.100197.
9. B. Hansen et al., “Protocol for a multicentre cross-sectional, longitudinal ambulatory clinical trial in rheumatoid arthritis and Parkinson’s disease patients analysing the relation between the gut microbiome, fasting and immune status in Germany (ExpoBiome),” BMJ Open, vol. 13, no. 8, p. e071380, Aug. 2023, doi: 10.1136/bmjopen-2022-071380.
10. A. M. Hartmann et al., “Post Hoc Analysis of a Randomized Controlled Trial on Fasting and Plant-Based Diet in Rheumatoid Arthritis (NutriFast): Nutritional Supply and Impact on Dietary Behavior,” Nutrients, vol. 15, no. 4, Art. no. 4, Jan. 2023, doi: 10.3390/nu15040851.