Peu après le début de la pandémie, il est devenu évident que certaines personnes présentaient des symptômes persistants au-delà de la phase aiguë de l’infection initiale. C’est ce qu’on appelle désormais le syndrome post-COVID ou COVID long. Ce syndrome regroupe une série de symptômes qui persistent plusieurs semaines ou mois après l’infection initiale. Les symptômes les plus courants sont la fatigue, les difficultés cognitives (aussi appelées brouillard cérébral) et des douleurs articulaires et thoraciques.
Sur cette page, vous trouverez de plus amples informations sur le COVID long, son impact sur la santé et la société, les approches thérapeutiques actuelles et l’expérience acquise par l’équipe de l’étude FastCoV dans le cadre d’essais cliniques liés à l’alimentation.
Le COVID long est une complication aiguë qui survient dans environ 10 % des cas après une infection par le SARS-CoV-2. L’Organisation mondiale de la santé (OMS) définit le COVID long comme un ensemble de symptômes apparaissant au moins trois mois après l’infection primaire, persistant pendant au moins deux mois et ne pouvant être attribués à aucun autre diagnostic.
La durée, l’intensité et la gravité des symptômes sont très variables. Ils comprennent fatigue, difficultés respiratoires, douleurs, dépression, anxiété et troubles cognitifs, souvent appelés « brouillard cérébral ». Ces symptômes ont souvent un impact sur les activités quotidiennes, les revenus et la qualité de vie. Les causes sous-jacentes du COVID long font encore l’objet de recherches.
Les hypothèses actuelles se concentrent sur :
- Un dysfonctionnement de la réponse immunitaire et inflammatoire
- Des dommages au niveau des vaisseaux sanguins
- Une perturbation du métabolisme cellulaire
- Une perturbation du système digestif et de son microbiote
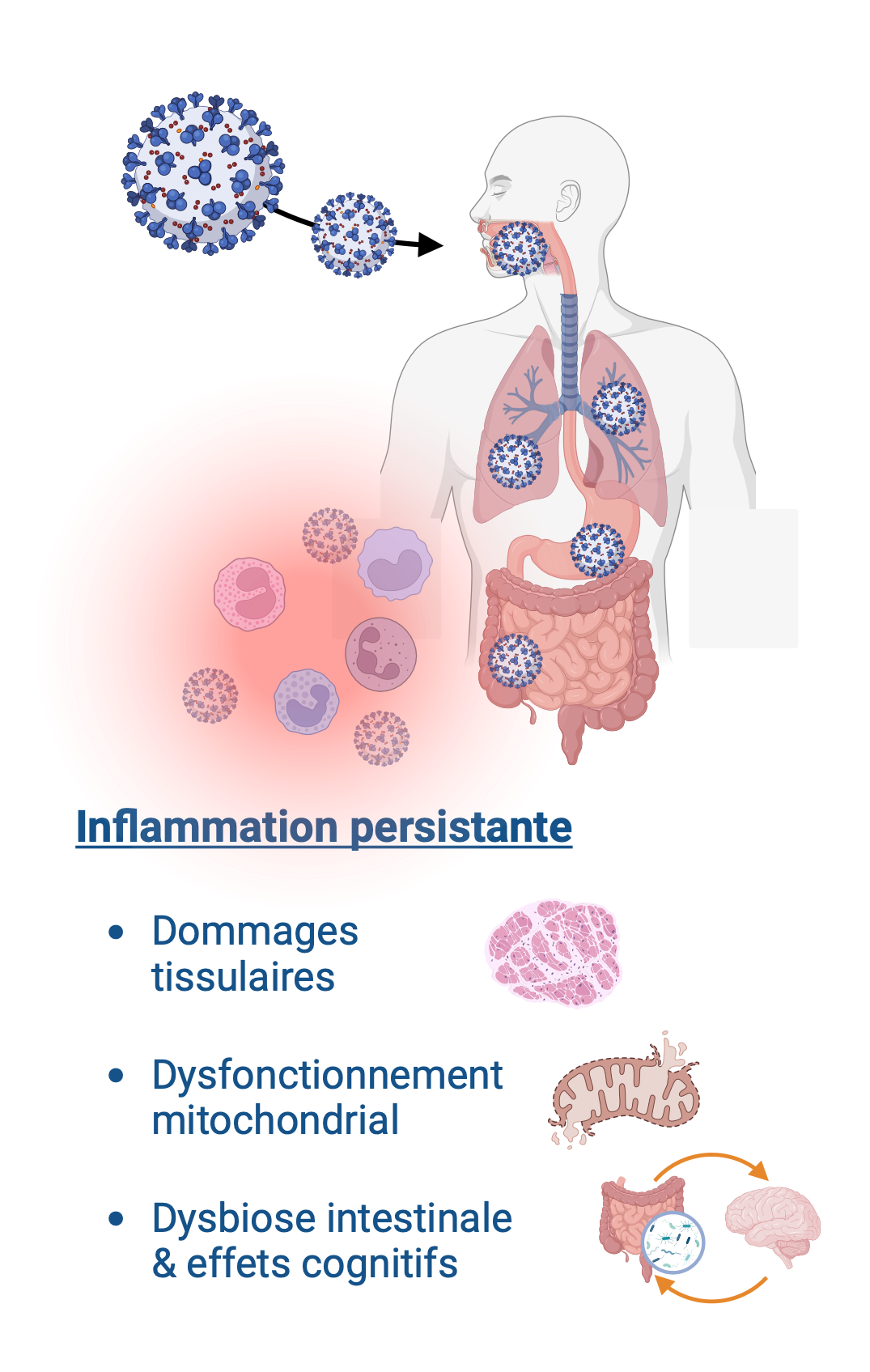
Les scientifiques pensent que l’infection initiale déclenche une réponse immunitaire qui, dans le cadre d’un mécanisme de défense normal, entraîne une inflammation. Dans certains cas, cette réponse immunitaire pourrait être excessive ou mal régulée, conduisant à une inflammation prolongée et à des dommages au niveau de différents organes. Ce processus existe dans d’autres maladies chroniques telles que la polyarthrite rhumatoïde, le diabète et les maladies neurodégénératives.
Actuellement, plus de 65 millions de personnes dans le monde sont touchées par le COVID long, la plupart des patients étant âgés de 36 à 50 ans. Dans la majorité des cas, les personnes ne sont pas hospitalisées et souffrent de symptômes qui affectent leur santé et leur vie privée. En outre, le COVID long a des répercussions sur la société car de nombreux patients doivent réduire leur temps de travail ou quitter leur emploi. Cela a des conséquences socio-économiques avec notamment une augmentation du taux d’absentéisme, une baisse de la productivité et une augmentation de l’isolement social et de la détresse psychologique.
Jusqu’à présent, la prise en charge des patients passe par des plans de traitement personnalisés, adaptés aux symptômes de chacun et visant à améliorer autant que possible leur qualité de vie. Ces traitements symptomatiques ne s’attaquent toutefois pas aux causes de la maladie, qui sont par ailleurs encore mal connues. Différents traitements anti-inflammatoires, antiviraux ou immunomodulateurs sont en cours de développement et semblent prometteurs mais leur efficacité n’a pas encore été démontrée. Des travaux de recherche sont donc nécessaires pour mieux comprendre la maladie et développer des solutions thérapeutiques alternatives.
Des études récentes indiquent que la restriction calorique et le jeûne thérapeutique peuvent limiter les processus inflammatoires potentiellement impliqués dans le COVID long. Le jeûne accompagné médicalement a en effet des effets bénéfiques connus dans le cas d’autres syndromes inflammatoires et favorise la diversité microbienne dans l’intestin. Une étude a par exemple montré que 13 sur 14 patients souffrant de maladies inflammatoires chroniques de l’intestin qui jeûnaient sous suivi médical ont vu leurs symptômes s’améliorer.
Dans le cas du COVID long, le jeûne pourrait donc permettre de moduler les interactions complexes entre la réponse immunitaire, le métabolisme et le microbiote intestinal. Cependant, les études cliniques sur le sujet sont compliquées à mettre en place de par le manque de protocoles de jeûne standardisés. De plus, évaluer de façon objective le respect du protocole par les participants reste difficile, ce qui peut compromettre la validité et la reproductibilité des résultats obtenus. Le projet FastCov vise à combler ces lacunes, notamment grâce à une phase pilote pour évaluer la faisabilité.
L’équipe de l’étude FastCov est composée de chercheurs de différentes institutions luxembourgeoises et allemandes. Ensemble, ils disposent d’une large expérience portant notamment sur les effets de l’alimentation sur la santé.
Les chercheurs du Luxembourg Centre for Systems Biomedicine (LCSB) de l’Université du Luxembourg ont par exemple récemment étudié l’influence du régime alimentaire sur les fonctions cognitives des personnes atteintes de maladies neurodégénératives. Ils ont cherché à savoir si des choix diététiques ciblés pouvaient avoir un effet bénéfique. Avec leurs collègues du Department of Life Sciences and Medicine, ils ont aussi développé le protocole d’ExpoBiome, une étude clinique multicentrique qui examine les liens entre le microbiote intestinal, le jeûne et le statut immunitaire chez les patients atteints de polyarthrite rhumatoïde et de la maladie de Parkinson.
L’équipe de l’hôpital universitaire de la Charité à Berlin a contribué à l’étude NutriFast, qui examine l’efficacité du jeûne thérapeutique et de l’alimentation végétale chez les personnes atteintes de polyarthrite rhumatoïde. En analysant des gouttes de sang séché, les chercheurs ont pu identifier plusieurs métabolites qui sont surexprimés pendant le jeûne et mettre en évidence des voies spécifiques impliquées dans la réponse à la restriction calorique.
En tant que participant à l’étude FastCoV, vous serez accompagné par cette équipe expérimentée tout au long de l’étude, de la première séance d’information jusqu’au retour progressif à une alimentation normale, en passant par des rendez-vous réguliers pendant la phase de jeûne,
1. A. V. Raveendran, R. Jayadevan, and S. Sashidharan, “Long COVID: An overview,” Diabetes Metab. Syndr., vol. 15, no. 3, pp. 869–875, 2021, doi: 10.1016/j.dsx.2021.04.007.
2. D. L. Sykes, L. Holdsworth, N. Jawad, P. Gunasekera, A. H. Morice, and M. G. Crooks, “Post-COVID-19 Symptom Burden: What is Long-COVID and How Should We Manage It?,” Lung, vol. 199, no. 2, pp. 113–119, Apr. 2021, doi: 10.1007/s00408-021-00423-z.
3. L. Kohn et al., “Long COVID and return to work: a qualitative study,” Occup. Med. Oxf. Engl., vol. 74, no. 1, pp. 29–36, Feb. 2024, doi: 10.1093/occmed/kqac119.
4. M. S. Durstenfeld et al., “Association of nirmatrelvir for acute SARS-CoV-2 infection with subsequent Long COVID symptoms in an observational cohort study,” J. Med. Virol., vol. 96, no. 1, p. e29333, 2024, doi: 10.1002/jmv.29333.
5. X. Y. Loke, S. A. M. Imran, G. J. Tye, W. S. Wan Kamarul Zaman, and F. Nordin, “Immunomodulation and Regenerative Capacity of MSCs for Long-COVID,” Int. J. Mol. Sci., vol. 22, no. 22, Art. no. 22, Jan. 2021, doi: 10.3390/ijms222212421.
6. N. Nagata et al., “Human Gut Microbiota and Its Metabolites Impact Immune Responses in COVID-19 and Its Complications,” Gastroenterology, vol. 164, no. 2, pp. 272–288, Feb. 2023, doi: 10.1053/j.gastro.2022.09.024.
7. F. Grundler, R. Mesnage, A. Cerrada, and F. Wilhelmi de Toledo, “Improvements during long-term fasting in patients with long COVID – a case series and literature review,” Front. Nutr., vol. 10, p. 1195270, Nov. 2023, doi: 10.3389/fnut.2023.1195270.
8. B. Hansen, K. Roomp, H. Ebid and J.-G. Schneider. « Perspective: The Impact of Fasting and Caloric Restriction on Neurodegenerative Diseases in Human, » Adv Nutr. 2024 Apr;15(4):100197. doi: 10.1016/j.advnut.2024.100197.
9. B. Hansen et al., “Protocol for a multicentre cross-sectional, longitudinal ambulatory clinical trial in rheumatoid arthritis and Parkinson’s disease patients analysing the relation between the gut microbiome, fasting and immune status in Germany (ExpoBiome),” BMJ Open, vol. 13, no. 8, p. e071380, Aug. 2023, doi: 10.1136/bmjopen-2022-071380.
10. A. M. Hartmann et al., “Post Hoc Analysis of a Randomized Controlled Trial on Fasting and Plant-Based Diet in Rheumatoid Arthritis (NutriFast): Nutritional Supply and Impact on Dietary Behavior,” Nutrients, vol. 15, no. 4, Art. no. 4, Jan. 2023, doi: 10.3390/nu15040851.