Am Tag der seltenen Erkrankungen 2025 wird das Luxembourg Centre for Systems Biomedicine (LCSB) Gebäude der Universität Luxemburg wieder in den Farben blau, grün, rosa und violett beleuchtet und sich damit anderen Gebäuden in Luxemburg und auf der ganzen Welt anschließen. Dieses Zeichen der Solidarität wird in Zusammenarbeit mit ALAN, der luxemburgischen Vereinigung für seltene Erkrankungen, organisiert und ist eine Widmung an die 300 Millionen Menschen weltweit, die mit einer der mehr als 6.000 bekannten seltenen Erkrankungen diagnostiziert wurden, davon 30.000 Menschen in Luxemburg. Viele dieser Krankheiten beginnen in der Kindheit, sind schwerwiegend und noch immer unheilbar. Sie haben daher tiefgreifende Auswirkungen auf Patienten, Familien und deren Betreuer. Der Tag der seltenen Erkrankungen macht deutlich, wie wichtig es ist, die Forschung voranzutreiben und mehr in sie zu investieren, um wirksame Behandlungen oder sogar Heilungen zu entwickeln. Ein Ziel des LCSB ist es, die genetischen und molekularen Mechanismen seltener Stoffwechselkrankheiten aufzuklären. Die Enzymology and Metabolism Gruppe, unter der Leitung von Prof. Carole Linster ist dabei führend auf diesem Gebiet.
Fortschritte in der Erforschung seltener Stoffwechselerkrankungen
Die Forschungsgruppe setzt modernste biochemische und Omics-Techniken ein, um seltene Stoffwechselerkrankungen und mögliche Therapiestrategien zu erforschen. So hat die Gruppe zum Beispiel in Zusammenarbeit mit internationalen Partnern eine seltene Kinderkrankheit namens PEBEL entdeckt, die auf Mutationen in den Genen NAXD oder NAXE beruht. Diese Genmutationen stören das körpereigene Stoffwechsel-Reparatursystem, das normalerweise wie eine zelluläre „Reinigungskolonne“ schädliche Nebenprodukte beseitigt. Fällt dieser Reinigungsprozess aus, sammeln sich schädliche Substanzen an, was zu fortschreitenden Hirnschäden und anderen schweren Symptomen führt, wie sie bei PEBEL beobachtet werden.
Auf Grundlage der Arbeit des Teams fanden die Kliniker heraus, dass Niacin (eine Form von Vitamin B3) dazu beitragen könnte, einige der mit diesen genetischen Mutationen verbundenen Symptome zu lindern. In einem kürzlich in der Fachzeitschrift Cellular & Molecular Biology Letters veröffentlichten Artikel haben Prof. Carole Linster und ihr Team diese Idee weiterverfolgt. Sie verwendeten Zellkulturen, um eine Theorie zu testen, die ursprünglich anhand eines Hefemodells entwickelt worden war. Ihre Experimente bestätigten, dass in Zellen, denen das Enzym NAXD fehlt, schädliche Stoffwechselprodukte gebildet werden. Diese Stoffwechselprodukte blockieren die Aktivität eines anderen wichtigen Enzyms, der 3-Phosphoglycerat-Dehydrogenase, das eine Schlüsselrolle in der Biosynthese von Serin spielt. Ohne ausreichend Serin sind viele zelluläre Prozesse gestört, was die Symptome bei Kindern mit PEBEL erklären könnte. Die Forscher fanden auch heraus, dass sich diese Störung des Stoffwechsels verstärkt, wenn die Zellen metabolischem Stress ausgesetzt sind.
Außerdem fand das Team einen Wirkstoff, der den Zellen hilft, sich zu erholen: Gibt man ihnen Nicotinamid-Ribosid (NR), einer anderen Form von Vitamin B3, und Inosin, verbessert sich die Serinproduktion und die Zellfunktion. „Wir haben die bekannte positive Wirkung einer Vitamin B3-Gabe bestätigt, und gleichzeitig auch festgestellt, dass NR und andere Nahrungsergänzungsmittel wie Inosin eine noch bessere Wirkung haben könnten, entweder als Ersatz für Vitamin B3 oder in Kombination“, erklärt Prof. Linster. „In Zellkulturmodellen gewinnen wir tiefere Einblicke in die molekularen Mechanismen der Krankheit. Damit verbessern wir nicht nur unser Verständnis der beteiligten enzymatischen Prozesse, sondern eröffnen auch den Weg zu effektiveren und optimierten Behandlungsstrategien.“ Diese kleinen Moleküle könnten in der Tat vielversprechende therapeutische Kandidaten für seltene Stoffwechselerkrankungen wie die PEBEL-Krankheit sein.
Die Zusammenarbeit mit Forschern in Australien und interne Partnerschaften innerhalb des LCSB waren entscheidend für den Erfolg der Studie. Dazu gehören die Forschungsgruppe Developmental and Cellular Biology unter der Leitung von Prof. Jens Schwamborn und die Metabolomics and Lipidomics Platform. Zukünftige vorklinische Untersuchungen in Tiermodellen wie dem Zebrafisch und der Maus werden das therapeutische Potenzial dieser Substanzen weiter erforschen.
Von seltenen Erkrankungen lernen, um weiter verbreitete Stoffwechselstörungen zu bekämpfen
Aufbauend auf ihrer Erfahrung bei der Entdeckung von Enzymfunktionen und Stoffwechselstörungen haben die Forscher ihr Fachwissen kürzlich auf ein Gen angewandt, das in der menschlichen Bevölkerung häufiger mutiert und stark mit Vitamin-B12-Mangel assoziiert ist. Dieser Mangel wird wiederum mit neurodegenerativen Erkrankungen in Verbindung gebracht, insbesondere bei Menschen, die nur geringe Mengen des Vitamins über die Nahrung zu sich nehmen.
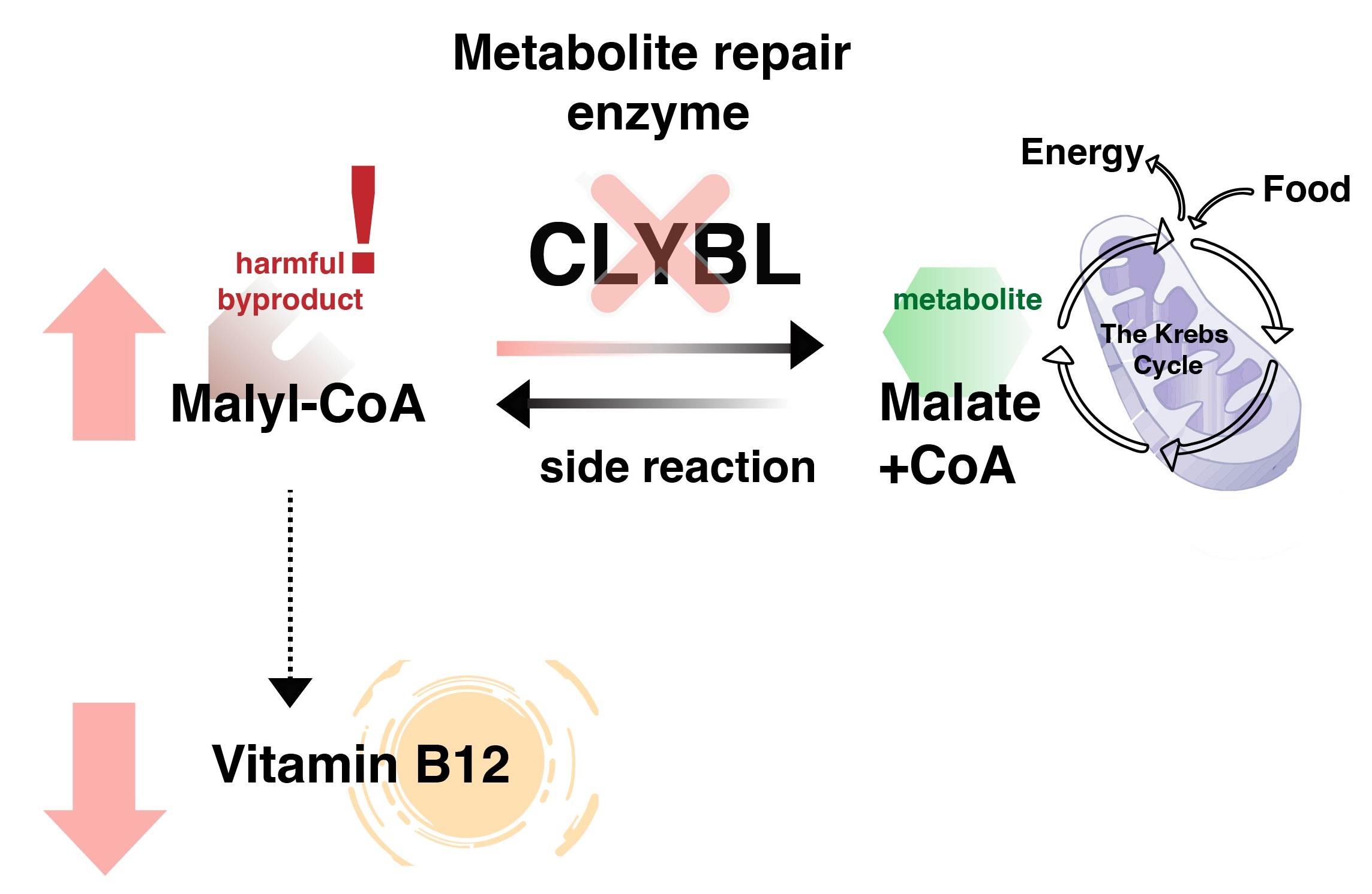
In ihrer neuesten Studie, die kürzlich in Nature Chemical Biology veröffentlicht wurde, entdeckten Prof. Carole Linster und ihr Team, dass dieses mit Vitamin B12 verknüpfte Gen für ein neues Stoffwechselreparatur-Enzym namens CLYBL kodiert.
CLYBL funktioniert wie eine „Reinigunstruppe“ die Malyl-CoA effizient abbaut, um Vitamin B12-abhängige Prozesse zu schützen. Mit Hilfe modernster Metabolomik-Techniken konnten die Wissenschaftler erstmals Malyl-CoA in menschlichen Zellen nachweisen und zeigen, dass es ein Nebenprodukt des Krebszyklus ist, des lebenswichtigen Prozesses, der dazu beiträgt, Nahrung in Energie umzuwandeln. Zugleich beeinflusst Malyl-CoA die Auswirkungen eines CLYBL-Defekts auf den Vitamin-B12-Stoffwechsel.
Interessanterweise ist eine Mutation im CLYBL-Gen, die zu einem Funktionsverlust führt und die Aktivität des Enzyms beeinträchtigt, nicht selten. Tatsächlich kommt diese Genvariante bei einem ungewöhnlich hohen Prozentsatz der Bevölkerung vor. „Obwohl diese Mutation in Zusammenhang mit Vitamin-B12-Mangel schädlich zu sein scheint, könnte sie einen evolutionären Vorteil darstellen, was ihr häufiges Vorkommen in der Bevölkerung erklärt. Dadurch könnte beispielsweise die Virulenz pathogener Bakterien eingeschränkt werden, die für ihr Wachstum und Überleben auf dieses Vitamin angewiesen sind“, betont Prof. Linster. „Unsere Ergebnisse stellen die Vorstellung in Frage, dass Störungen der Stoffwechselreparatur auf seltene Erkrankungen beschränkt sind. Wir sehen hier, wie eine häufige genetische Variation den Vitaminstoffwechsel in einem bedeutenden Teil der Bevölkerung beeinflussen kann.“
In Zukunft wird es interessant sein zu untersuchen, ob Personen mit einem CLYBL-Mangel ein erhöhtes Risiko für die Entwicklung neurologischer Probleme haben und ob sie von Vitamin B12-Einnahme profitieren würden.
Sensibilisierung und Einbeziehung der Gesellschaft
Neben der Forschung engagiert sich das LCSB auch für die Sensibilisierung und Unterstützung von Menschen, die von seltenen Krankheiten betroffen sind. Bei den Researcher’s Days 2024, einer alle zwei Jahre stattfindenden Veranstaltung, die vom Luxembourg National Research Fund (FNR) organisiert wird, hat die Gruppe Enzymology and Metabolism interaktive Workshops über seltene Krankheiten organisiert. Hunderte von Besuchern aller Altersgruppen konnten den genetischen Code entschlüsseln, mit Enzymen experimentieren und erfahren, wie seltene Krankheiten in Zellen und Zebrafischen untersucht oder bei Kindern diagnostiziert werden.
Das LCSB setzt die Tradition fort, die im vergangenen Jahr begann, als das Biotech II-Gebäude in Belval zum ersten Mal in den Farben des Tages der seltenen Erkrankung beleuchtet wurde. Es setzt sich weiterhin dafür ein, das Bewusstsein für seltene Erkrankungen zu schärfen und Patienten durch innovative Wissenschaft, Zusammenarbeit und Öffentlichkeitsarbeit zu unterstützen. Die Wissenschaftler des LCSB sind bestrebt, Krankheitsmechanismen zu erforschen und so neue Behandlungsansätze zu schaffen. Zu diesem Zweck hat das LCSB kürzlich einen Forschungsfonds für seltene Kinderkrankheiten eingerichtet. Jede Spende kann helfen, die lebenswichtige Forschung zu beschleunigen und Kindern und ihren Familien, die von seltenen Krankheiten betroffen sind, Hoffnung zu geben.
—
Aktuelle Publikationen :
- Walvekar AS, Warmoes M, Cheung D, Sikora T, Seyedkatouli N, Gomez-Giro G, Perrone S, Dengler L, Unger F, Santos BFR, Gavotto F, Dong X, Becker-Kettern J, Kwon YJ, Jäger C, Schwamborn JC, Van Bergen NJ, Christodoulou J & Linster CL. Failure to repair damaged NAD(P)H blocks de novo serine synthesis in human cells. Cellular & Molecular Biology Letters. January 2025.
- Griffith CM, Conrotte JF, Paydar P, Xie X, Heins-Marroquin U, Gavotto F, Jäger C, Ellens KW, Linster CL. CLYBL averts vitamin B12 depletion by repairing malyl-CoA. 2025, Nature Chemical Biology, March 2025.
Finanzierung:
Diese Forschung wurde von der Universität Luxemburg, dem Nationalen Forschungsfonds Luxemburgs (FNR), dem Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union und einer Spende der Juniclair Foundation unterstützt.




