Die Alzheimer-Krankheit ist die häufigste Ursache von Demenz. Sie betrifft nicht alle Menschen gleichermaßen: Frauen haben ein höheres Erkrankungsrisiko, selbst wenn man berücksichtigt, dass sie im Allgemeinen länger leben als Männer. Außerdem sind bei ihnen die Symptome oft schwerer als bei Männern. Welche molekularen Mechanismen diesen Unterschieden zugrunde liegen, war bislang unklar. Eine neue Studie unter der Leitung von Prof. Enrico Glaab vom Luxembourg Centre for Systems Biomedicine (LCSB) der Universität Luxemburg hat nun geschlechtsspezifische molekulare Veränderungen bei der Alzheimer-Krankheit in verschiedenen Zelltypen des Gehirns nachgewiesen, die neue Angriffspunkte für personalisierte Therapieansätze bieten könnten. Die Studie wurde kürzlich in der Zeitschrift Alzheimer’s & Dementia veröffentlicht.
Einblick in einzelne Zellen
Mit Hilfe modernster Einzelzellanalysen untersuchte das Forscherteam mehr als 2,3 Millionen Gehirnzellen, darunter sowohl Nervenzellen als auch verschiedene Arten von Gliazellen, von Alzheimer-Patienten und gesunden Kontrollpersonen, die ihr Gehirn nach ihrem Tod für der Forschung zur Verfügung gestellt hatten. Sie interessierten sich insbesondere für den präfrontalen Kortex, einen Bereich des Gehirns, der für die Entscheidungsfindung und den Abruf von Erinnerungen wichtig ist. Die Forscher maßen die Expression Tausender Genen in einzelnen Zellen – ein Verfahren, das auch als Einzelzell-Transkriptomik bezeichnet wird. Anschließend verglichen sie die Veränderungen zwischen Patienten und gesunden Kontrollpersonen, aber auch zwischen den beiden Geschlechtern in der betroffenen und der nicht betroffenen Gruppe, um nach geschlechtsspezifischen Veränderungen zu suchen. Dieser innovative Ansatz ermöglichte ihnen eine detaillierte Analyse der Genaktivität und der zelluläre Prozesse in mehreren Zelltypen des Gehirns, die bei der Alzheimer-Krankheit eine Rolle spielen.
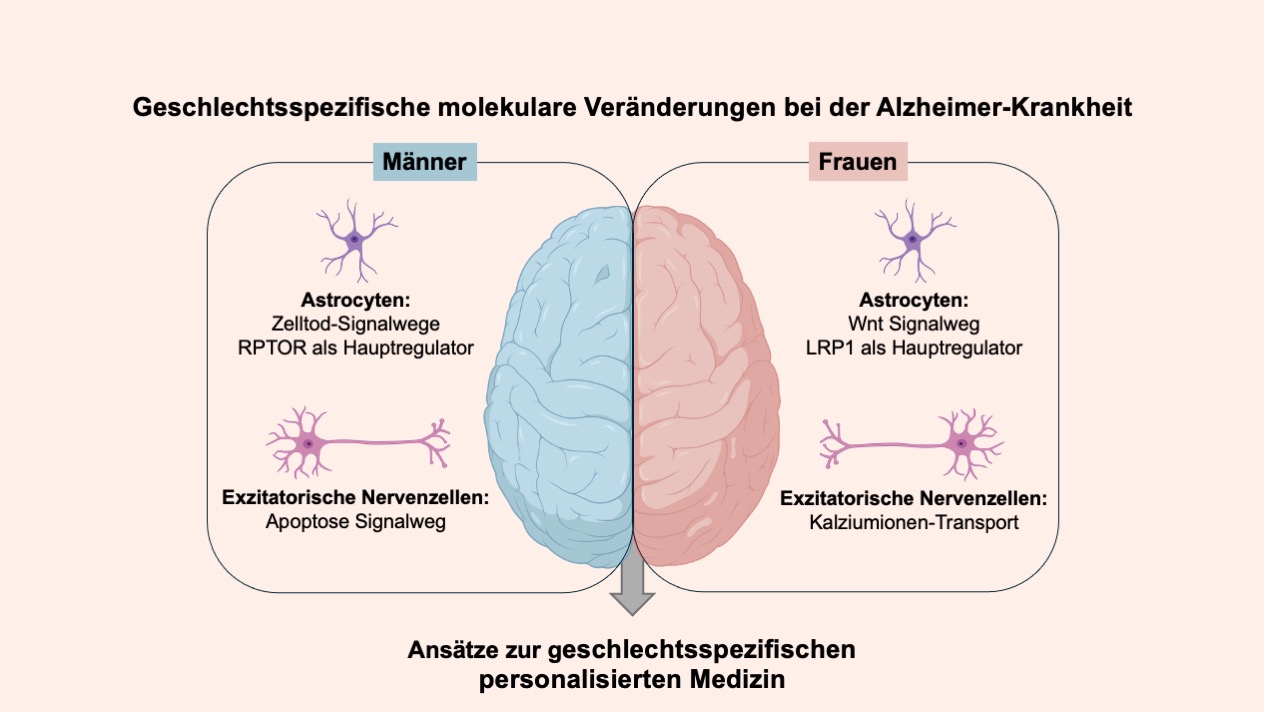
Die Ergebnisse zeigten molekulare Unterschiede zwischen Männern und Frauen mit Alzheimer. Bei männlichen Patienten zeigten Astrozyten, eine Unterart der Gliazellen, die für metabolische, strukturelle, homöostatische und neuroprotektive Funktionen verantwortlich sind, signifikante Veränderungen in Signalwegen, die mit dem Zelltod in Verbindung stehen. Im Gegensatz dazu zeigten weibliche Patienten Veränderungen in Signalwegen, die an der Zell-Zell-Kommunikation und der Wachstumsregulation beteiligt sind. „Indem wir uns auf einzelne Zellen konzentrieren, können wir geschlechtsspezifische Krankheitsmechanismen und subtile Unterschiede zwischen den Zelltypen des Gehirns untersuchen, die andernfalls verborgen bleiben“, erklärt Mohamed Soudy, Doktorand in der Biomedical Data Science Forschungsgruppe am LCSB und Erstautor der Studie.
Geschlechtsspezifische Unterschiede in der Zell-Zell-Kommunikation bei Alzheimer-Patienten
Ein wesentliches Merkmal der Alzheimer-Krankheit ist eine gestörte Kommunikation zwischen den Zellen, die zum Absterben von Nervenzellen und zu einem weitreichenden Verlust der Hirnfunktionen führt. Die Forscher fanden Hinweise darauf, dass einige dieser Kommunikationsstörungen bei Männern und Frauen unterschiedlich stark ausgeprägt sind. Die Gehirne von männlichen Alzheimer-Patienten zeigten ausgeprägte Veränderungen bei Zelltod-Signalwegen, während die Gehirne von Frauen eine veränderte Kalzium-Signalgebung aufwiesen, ein Schlüsselprozess für die Gehirnfunktion und das Gedächtnis. „Diese geschlechtsspezifischen Unterschiede und das komplexe Zusammenspiel zellulärer Prozesse liefern ein deutlicheres Bild davon, wie sich Alzheimer bei Männern und Frauen unterschiedlich manifestiert“, sagt Forscherin Dr. Sophie LeBars, die die Studie mitverfasst hat.
Unterschiedliche Angriffspunkte für Männer und Frauen
Auf der Suche nach möglichen Angriffspunkten für Medikamente nutzten die Forscher Computermodelle, die darstellen, wie molekulare Regulatoren miteinander und mit anderen Substanzen in der Zelle interagieren, um die Genaktivität zu steuern. Durch die systematische Analyse dieser zelltypspezifischen genregulatorischen Netzwerke und die Simulation möglicher Arzneimittelwirkungen konnten wichtige regulatorische Moleküle als potenzielle Arzneimittelziele identifiziert werden, die geschlechtsabhängige pathologische Veränderungen rückgängig machen könnten. Bei männlichen Patienten wurde RPTOR, ein Molekül, das für das Überleben und den Stoffwechsel von Zellen wichtig ist, als potenzieller Mediator der geschlechtsspezifischen Veränderungen bei der Alzheimer-Krankheit identifiziert. Bei weiblichen Patienten identifizierten die Forscher LRP1 als ein wichtiges regulatorisches Molekül. Dieses Protein spielt eine wichtige Rolle bei der Beseitigung toxischer Proteine wie Amyloid-beta aus dem Gehirn. Die Position von LRP1 als zentraler Mediator in frauenspezifischen Gennetzwerken bei Alzheimer legt nahe, dass es als Ziel für geschlechtsspezifische Therapien weiter untersucht werden sollte.
„Diese Ergebnisse unterstreichen die Vorteile der Berücksichtigung des Geschlechts als wichtige biologische Variable in der Alzheimer-Forschung“, sagt Prof. Enrico Glaab, Leiter der Biomedical Data Science Forschungsgruppe und Hauptautor der Studie. „Die Anpassung von Behandlungen an solche molekularen Unterschiede könnte die therapeutische Wirksamkeit verbessern und den Weg zu einer stärker personalisierten Medizin ebnen. Ein Ansatz, der dringend benötigt wird, da die Alzheimer-Krankheit weltweit weiter zunimmt.
Wissenschaftliche Publikation: Mohamed Soudy, Sophie Le Bars and Enrico Glaab, Sex-dependent molecular landscape of Alzheimer’s disease revealed by large-scale single-cell transcriptomics, Alzheimer’s & Dementia, December 2024.
