La maladie de Parkinson est une maladie neurodégénérative bien connue mais la façon dont elle se propage dans le cerveau des patients reste mal comprise. Il est donc essentiel de mieux comprendre comment les agrégats de protéines toxiques se déplacent entre les régions du cerveau pour élucider les mécanismes impliqués dans la progression de la maladie, notamment aux stades précoces. Des chercheurs du Luxembourg Centre for Systems Biomedicine (LCSB) et des collaborateurs internationaux viennent justement d’observer la propagation progressive d’agrégats d’alpha-synucléine dans des assembloïdes cérébraux obtenus à partir de cellules de patients. Cette étude, publiée dans Advanced Science, apporte de nouvelles informations sur la manière dont la maladie de Parkinson progresse d’une zone du cerveau à une autre.
Étudier la propagation des agrégats de protéines
Si la maladie de Parkinson est associée à des symptômes tels que les tremblements, la rigidité musculaire et le ralentissement des mouvements, elle débute en fait de façon silencieuse, bien avant l’apparition de ces symptômes moteurs. La présence de symptômes non moteurs précoces a conduit les chercheurs à s’interroger sur la manière dont la maladie se propage dans le système nerveux au fil du temps. L’une des théories principales, proposée pour la première fois par l’anatomiste allemand Heiko Braak, suggère que la maladie de Parkinson pourrait commencer au niveau l’intestin ou du le tronc cérébral inférieur, avant de remonter progressivement vers le cerveau selon un schéma spécifique. Toutefois, les mécanismes précis derrière cette propagation restent inconnus.
Une protéine appelée alpha-synucléine est au cœur de la maladie. Dans un cerveau en bonne santé, elle contribue à réguler la communication entre les neurones. Dans la maladie de Parkinson, cette protéine se replie mal et s’agrège, endommageant les cellules nerveuses et formant des structures anormales, connues sous le nom de corps de Lewy, caractéristiques de la maladie. Il est essentiel de comprendre comment ces agrégats se propagent entre les différentes régions du cerveau pour mettre au point de nouvelles stratégies thérapeutiques. Pour relever ce défi, l’équipe Developmental & Cellular Biology du LCSB, dirigée par le professeur Jens Schwamborn, a collaboré avec des chercheurs de l’Université technique d’Eindhoven, de l’hôpital universitaire Schleswig-Holstein à Lübeck et de l’Institut Pasteur hellénique d’Athènes pour recréer les premiers stades de la maladie de Parkinson en laboratoire à l’aide d’un outil innovant : les assembloïdes cérébraux.
Un nouveau modèle pour la recherche sur la maladie de Parkinson
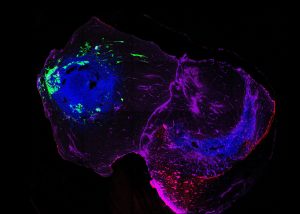
Pour étudier la progression de la maladie, les chercheurs ont mis au point des assembloïdes en fusionnant deux types d’organoïdes cérébraux : des structures tridimensionnelles miniatures obtenues en laboratoire à partir de cellules souches humaines. Un des deux organoïdes est un modèle du cerveau postérieur, la région où on pense que la maladie de Parkinson débute, et le deuxième représente le mésencéphale, la zone où se trouvent les neurones producteurs de dopamine qui sont détruits par la maladie.
En utilisant des cellules souches pluripotentes induites issues de patients présentant une triplication rare du gène SNCA, une mutation qui entraîne une surproduction d’alpha-synucléine, les chercheurs ont constaté que les organoïdes représentant le cerveau postérieur développaient spontanément des agrégats de protéines toxiques. Lorsque ces organoïdes ont été reliés aux organoïdes sains représentant le mésencéphale pour former des assembloïdes, les agrégats d’alpha-synucléine ont commencé à se répandre dans le tissu cérébral sain en l’espace de 30 jours seulement.
« Ce modèle d’assembloïde obtenu à partir de cellules de patients nous donne un aperçu sans précédent de la manière dont la forme toxique de l’alpha-synucléine s’accumule et se propage entre les régions du cerveau », souligne le professeur Jens Schwamborn. « C’est la première fois que nous avons pu observer la progression de ces agrégats dans un modèle humain sans avoir à surexprimer certaines protéines ou à provoquer leur agrégation de façon artificielle. » L’étude vient donc soutenir l’hypothèse de Braak en démontrant que les agrégats toxiques d’alpha-synucléine peuvent se propager d’une région cérébrale à l’autre.
L’alpha-synucléine et son rôle dans la progression de la maladie
L’étude a ainsi montré qu’un excès d’alpha-synucléine dans le cerveau postérieur était suffisant pour déclencher sa propagation vers le mésencéphale et avoir un impact sur les synapses, les points de communication vitaux entre les neurones. En effet, avant même que les neurones ne commencent à mourir, les chercheurs ont observé des signes précoces de dysfonctionnement synaptique, une étape clé de la neurodégénérescence.
« L’augmentation de la quantité d’alpha-synucléine dans le cerveau postérieur a déclenché la propagation de la forme toxique de la protéine vers le mésencéphale sain, entraînant un dysfonctionnement synaptique », détaille le professeur Schwamborn. « Cela montre que les assembloïdes cérébraux constituent un bon modèle pour étudier le processus de propagation et pour développer des approches thérapeutiques inhibant ce processus ».
Dans ces assembloïdes, les scientifiques ont par ailleurs utilisé des techniques de pointe telles que les réseaux de microélectrodes et le traçage viral pour s’assurer que les deux organoïdes formaient des connexions fonctionnelles et directionnelles similaires à ce qui s’observe entre les différentes régions du cerveau. À mesure que l’alpha-synucléine se propageait, ces connexions s’affaiblissaient, indiquant bien une perturbation précoce de l’activité cérébrale.
Vers une détection précoce et une médecine personnalisée
Les assembloïdes constituent donc un environnement idéal pour étudier la progression de la maladie de Parkinson avec un niveau de détail sans précédent. En imitant l’architecture et la connectivité du cerveau, ils devraient permettent de lever le voile sur les premiers stades de la maladie de Parkinson et de développer de nouvelles approches pour la médecine de précision. Comme chaque assembloïde est obtenu à partir de cellules d’un patient donné, les chercheurs peuvent en effet étudier l’impact du patrimoine génétique du patient sur le développement de la maladie et tester des traitements ciblés.
« Ce modèle nous donne l’opportunité d’étudier les mécanismes précoces de la maladie et de chercher des traitements susceptibles de bloquer la propagation de l’alpha-synucléine avant que des dommages irréversibles ne se produisent », explique le professeur Schwamborn. « À terme, cela pourrait déboucher sur des traitements préventifs pour les personnes à risque qui stopperaient la maladie avant qu’elle ne se propage. »
—
Publication scientifique: Gomez-Giro G, Frangenberg D, Vega D, Zagare A, Barmpa K, Antony PMA, Robertson G, Sabahi-Kaviani R, Haendler K, Kruse N, Papastefanaki F, Matsas R, Spielman M, Luttge R and Schwamborn JC. Alpha-synuclein pathology spreads in a midbrain-hindbrain assembloid model. Advanced Science, April 2025.
Financement: Ces travaux de recherche ont été soutenue par Horizon 2020, le programme de l’Union européenne pour la recherche et l’innovation.
Image de couverture: Gemma Gomez-Giro