La maladie d’Alzheimer, principale cause de démence, ne touche pas tout le monde de la même manière : le risque est plus élevé pour les femmes, même si l’on tient compte du fait qu’elles vivent en général plus longtemps que les hommes. En outre, elles présentent souvent des symptômes plus graves. Toutefois, les mécanismes à l’origine de ces différences ne sont pas encore bien compris. Une nouvelle étude vient cependant de mettre en évidence des changements à l’échelle moléculaire dans plusieurs types de cellules du cerveau qui diffèrent entre hommes et femmes atteints de la maladie d’Alzheimer, suggérant de nouvelles cibles pour des approches thérapeutiques personnalisées. L’étude, dirigée par le professeur Enrico Glaab du Luxembourg Centre for Systems Biomedicine (LCSB) de l’Université du Luxembourg, a été publiée récemment dans Alzheimer’s & Dementia.
Zoomer cellule par cellule
L’équipe a réalisé des analyses poussées, basées sur la technologie « single cell », pour plus de 2,3 millions de cellules cérébrales, dont des neurones et différents types de cellules gliales, provenant de personnes atteintes de la maladie d’Alzheimer et de témoins sains ayant fait don de leur cerveau à la recherche après leur mort. Les chercheurs se sont plus particulièrement intéressés au cortex préfrontal, une zone clé responsable de la prise de décision et de la récupération des souvenirs. Ils ont mesuré les niveaux d’expression de milliers de gènes dans chaque cellule, un processus également appelé transcriptomique en cellule unique. Ils ont ensuite comparé patients et témoins sains mais aussi hommes et femmes afin de rechercher des changements liés à la maladie dans chacun des sexes. Cette approche innovante leur a permis d’analyser avec une précision sans précédent l’activité des gènes et les processus cellulaires dans plusieurs types de cellules cérébrales impliqués dans la maladie d’Alzheimer.
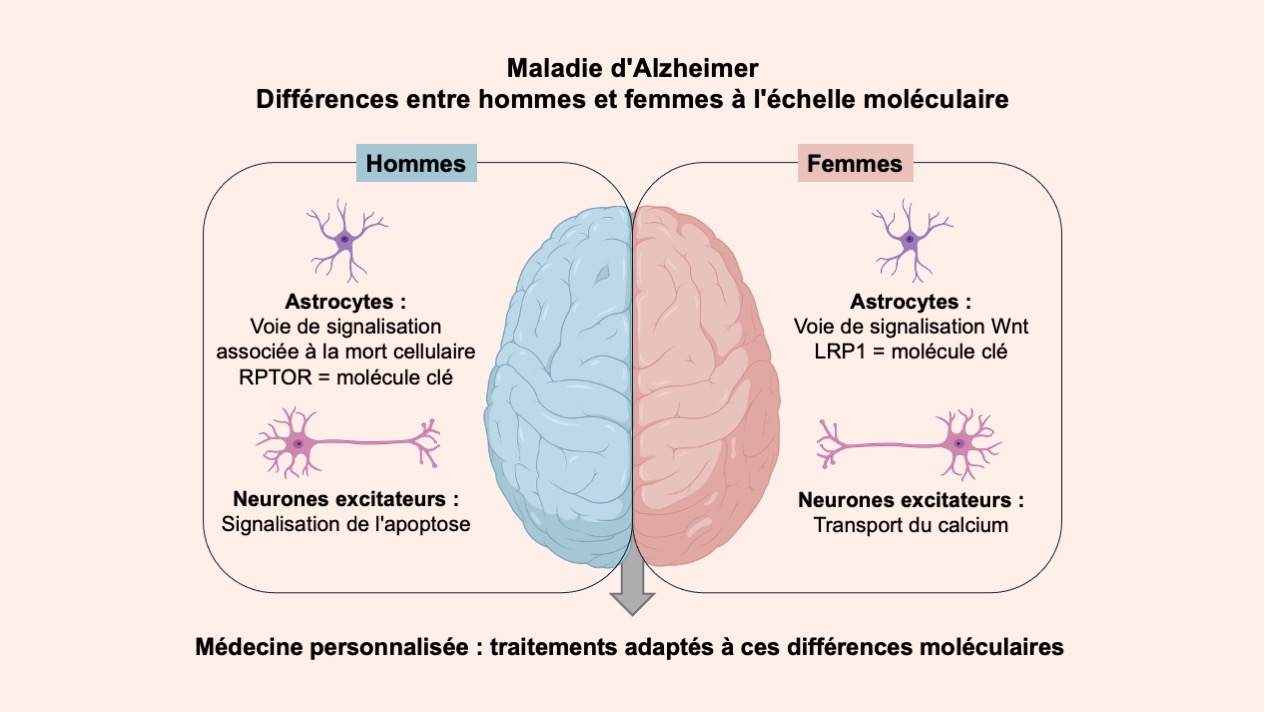
Leurs résultats ont révélé des signatures moléculaires distinctes chez les hommes et les femmes atteints de la maladie d’Alzheimer. Chez les patients de sexe masculin, les chercheurs ont observé des changements significatifs dans les voies associées à la mort cellulaire au niveau des astrocytes, un sous-type de cellules gliales responsables des fonctions métaboliques, structurelles, homéostatiques et neuroprotectrices. Les patientes présentaient en revanche des altérations des voies impliquées dans la communication cellulaire et la régulation de la croissance. « En nous plaçant à l’échelle de la cellule unique, nous pouvons étudier les mécanismes pathologiques dépendants du sexe et les différences subtiles entre les divers types de cellules du cerveau qui pourraient autrement rester cachées, » explique Mohamed Soudy, doctorant au sein du groupe Biomedical Data Science du LCSB et premier auteur de l’étude.
Différences entre hommes et femmes au niveau de la communication cellulaire
L’une des principales caractéristiques de la maladie d’Alzheimer est la détérioration de la communication entre les cellules cérébrales qui entraîne la mort des neurones et une dégradation généralisée des fonctions cérébrales. Les observations des chercheurs indiquent que ce processus se manifeste différemment selon le sexe. Les cerveaux des patients présentaient des changements prononcés dans la signalisation de la mort cellulaire, tandis que les cerveaux des patientes montraient une altération de la signalisation du calcium, un processus clé dans les fonctions cérébrales et la mémoire. « Ces modifications propres à chacun des sexe et les interactions complexes entre les différentes processus cellulaires permettent de mieux comprendre pourquoi la maladie d’Alzheimer se présente différemment chez les hommes et les femmes, » explique Dr Sophie LeBars, post-doctorante et coauteur de l’étude.
Cibler les mécanismes propres à chaque sexe via des traitements adaptés
Pour rechercher de potentielles cibles sur lesquelles des médicaments pourraient agir, les chercheurs ont utilisé des modèles informatiques qui décrivent comment les régulateurs moléculaires interagissent entre eux et avec d’autres substances dans la cellule pour régir les niveaux d’expression des gènes. L’analyse systématique de ces réseaux de régulation génique pour différents types de cellule et la simulation des effets potentiels des médicaments ont permis de repérer des molécules clés. Les cibler pourraient permettre d’inverser les changements pathologiques propres à chaque sexe. Chez les patients de sexe masculin, RPTOR, une molécule impliquée dans la survie et le métabolisme des cellules, a été identifiée comme un médiateur potentiel des changements liés à la maladie d’Alzheimer. Chez les femmes, les chercheurs ont identifié LRP1 comme une molécule clé. Elle joue notamment un rôle important dans l’élimination des protéines toxiques, telles que l’amyloïde-bêta, du cerveau. Au vu de sa position centrale au sein des réseaux de régulation génique spécifiques aux femmes, elle mériterait d’être étudiée de plus près et considérée comme une possible cible pour des traitements adaptés.
« Ces résultats soulignent l’intérêt de considérer le sexe comme une variable biologique importante dans la recherche sur la maladie d’Alzheimer », déclare le professeur Enrico Glaab, responsable du groupe Biomedical Data Science et auteur principal de l’étude. « Adapter les traitements à ces différences moléculaires pourrait améliorer l’efficacité thérapeutique et ouvrir la voie à une médecine plus personnalisée. » Une approche qui s’impose d’urgence à un moment où la maladie d’Alzheimer a un impact grandissant sur nos sociétés.
Publication scientifique : Mohamed Soudy, Sophie Le Bars and Enrico Glaab, Sex-dependent molecular landscape of Alzheimer’s disease revealed by large-scale single-cell transcriptomics, Alzheimer’s & Dementia, December 2024.
